Glutaminaza 2 (GLS2) este un regulator principal al glutaminolizei. GLS2 transformă glutamina în glutamat, jucând astfel un rol în producția de energie celulară. GLS2 este abundentă în ficat și se găsește, de asemenea, în celulele β pancreatice. Cu toate acestea, rolul GLS2 în insulele pancreatice, unde sunt prezente atât celulele ɑ, cât și celulele β, asociat cu metabolismul glucozei este în prezent necunoscut.
Se știe că homeostazia glucozei este menținută printr-o interacțiune complexă și complicată între ficat, celulele ɑ- pancreatice (care produc glucagon), celulele β pancreatice (care produc insulină) și organele asociate, cum ar fi intestinele, mușchii scheletici și țesutul adipos.
Cercetătorii de la Universitatea Chiba din Japonia au identificat anterior GLS2 ca fiind o genă țintă pentru p53 (antigen tumoral), funcționând astfel ca un supresor de tumori. Deoarece diabetul și cancerul sunt strâns legate între ele, aceștia au decis să examineze în continuare rolul GLS2 specific celulelor β în homeostazia glucozei.
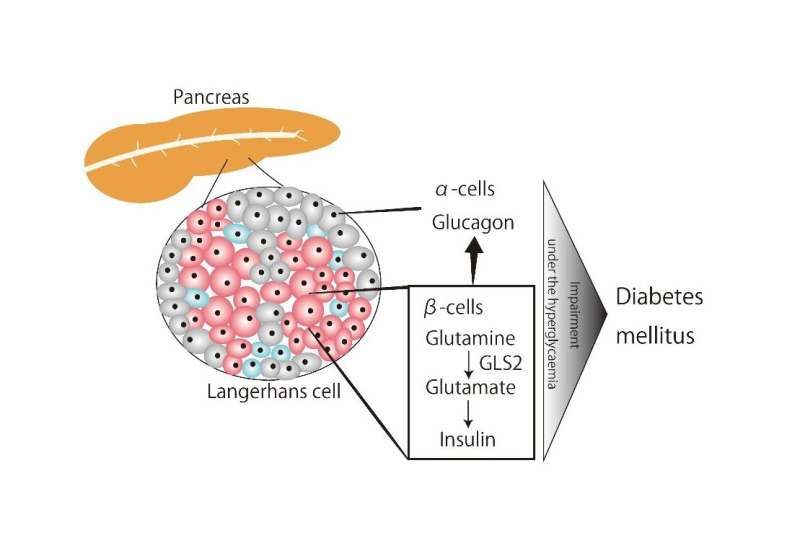
În studiul de față, ei au descoperit rolul GLS2 în homeostazia glucozei. Ei au făcut acest lucru folosind un model de șoarece, în care GLS2 a fost suprimat condiționat în celulele β pancreatice, cunoscut sub numele de șoareci GLS2 CKO, împreună cu un depozit de date genetice ale insulelor pancreatice umane.
“Studiile anterioare au identificat GLS2 ca fiind o țintă a p53, care guvernează feroptoza, și au arătat că GLS2 are o funcție supresoare de tumori. Știam, de asemenea, că metabolitul GLS2 al glutamatului a reglementat producția de insulină stimulată de glucoză și am emis ipoteza că enzima are un rol în homeostazia glucozei în insulele pancreatice. Acest studiu oferă informații importante, deoarece diabetul și cancerul ar putea avea o bază moleculară comună în patogeneza lor”, explică Dr. Sawako Suzuki, autorul principal al studiului.
Echipa de cercetare a comparat homeostazia glucozei între șoarecii Gls2 knockout (Gls2 CKO) și șoarecii de control (RIP-Cre).
“Atunci când au fost hrăniți cu o dietă bogată în grăsimi, am constatat că expresia GLS2 și p53 a crescut în celulele β pancreatice de la șoarecii RIP-Cre. În schimb, șoarecii Gls2 CKO au dezvoltat diabet zaharat, rezistență la insulină și o producție susținută de glucoză. În mod paradoxal, secreția de insulină a fost suprimată și secreția de glucagon a fost ridicată în ciuda nivelului ridicat de glucoză din sânge la șoarecii Gls2 CKO. Acest lucru arată că activitatea afectată a GLS2 determină apariția diabetului zaharat prin exacerbarea reglării perturbate a insulinei și glucagonului”, spune Dr. Suzuki.
Descoperirile grupului de cercetare au fost validate în experimente separate. Încă o dată, s-a observat că secreția de insulină a fost redusă. Mai mult, datele privind expresia genetică a celulelor insulare pancreatice umane provenite de la donatori diabetici au arătat o creștere a expresiei GLS2. În cele din urmă, în concordanță cu datele obținute în cazul șoarecilor cu Gls2, reducerea GLS2 în celulele β pancreatice de la donatorii diabetici a fost legată în mod paradoxal de suprimarea insulinei și de creșterea expresiei genei glucagonului.
Acest studiu subliniază faptul că dezvoltarea unor medicamente personalizate pentru diabetici trebuie să includă informațiile genetice ale pacientului, împreună cu datele privind nivelul glicemiei, starea metabolică, vârsta, durata diabetului și istoricul familial al bolii.
“Trebuie să aprofundăm mai mult metabolismul glucozei reglat de GLS2. Pacienții care au modificări ale genei GLS2 cu pierdere de funcție ar putea avea în mod inerent potențialul de a dezvolta diabet zaharat. În viitor, GLS2 ar putea fi chiar o țintă terapeutică pentru pacienții care suferă de această boală”, concluzionează Dr. Suzuki.
Material preluat și tradus de pe: https://medicalxpress.com/news/2023-07-glutaminase-glucose-metabolism-pancreatic-cells.html.











